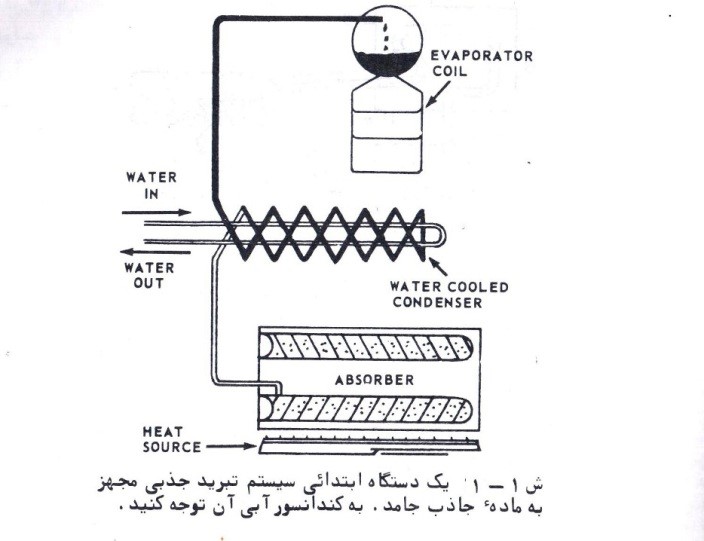
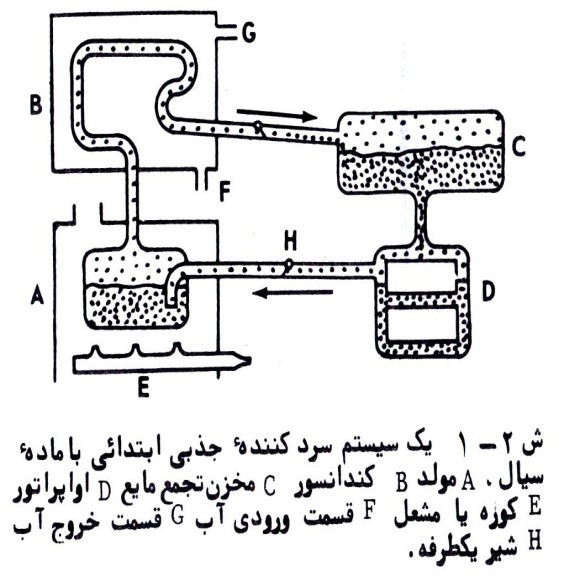
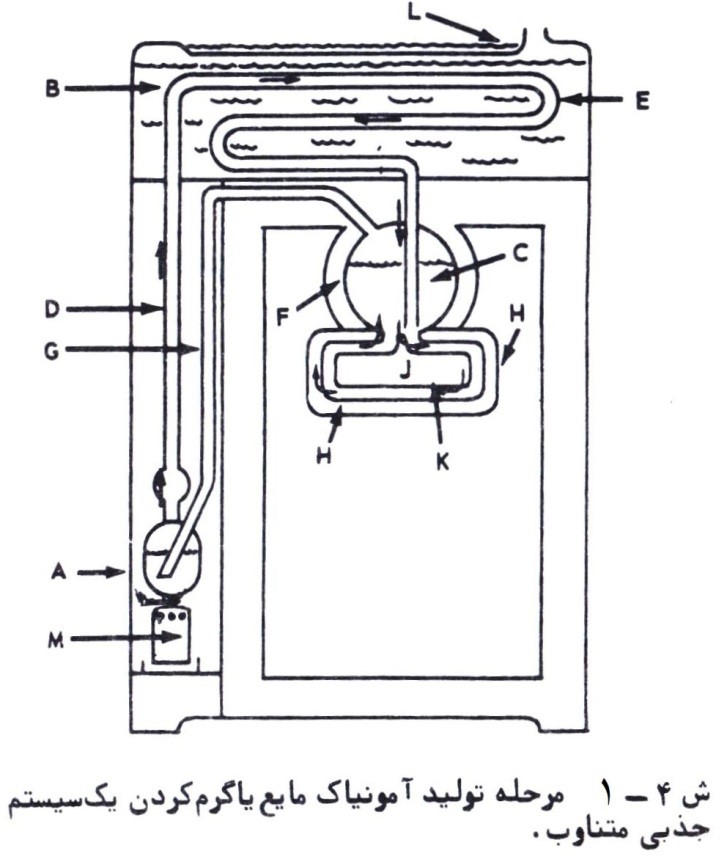
تحلیل ترمودینامیکی چرخه سرمایش
تبدیل انرژی به ویژه انرژی حراراتی و نسبت آن با حالت مواد، شاکله ی اصلی مباحث ترمودینامیکی است. از این رو موضوعات مرتبط با سرمایش و یا به عبارت دیگر کاهش گرما، بر پایه ی قواعد ترمودینامیک تحلیل می شوند.
یک سیستم ترمودینامیکی شامل فضا و کمیت مشخصی از مواد در حجمی مشخص است که به وسیله سطوحی از فضای خارج از این سیستم ، محیط اطراف خوانده می شود. مرزهای اطراف ممکن است ثابت یا غیر ثابت، واقعی یا فرضی باشند. این سیستم را می توان حجم کنترل نامید.
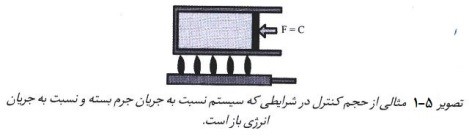
منظور از سیستم بسته، سیستمی نیست که نسبت به محیط اطراف کاملا ایزوله بوده و جریان انرژی و کار از مرزهای آن عبور نکند، بلکه این سیستم می تواند تحت تاثیر عوامل خارجی انرژی باشد، اما با محیط اطراف تبادل جرم نداشته باشد. منظور از بسته بودن سیستم مربوط به ساز و کار و چرخه ی عملکردی است. هر سیستم بسته ای می تواند در سیستم بسته دیگری جای گیرد و حتی جهان می تواند نسبت به کائنات به عنوان سیستم بسته ای فرض شود. تصویر 5-1 مثالی از یک حجم کنترل است که جریان انرژی از مرزهای آن(دیواره ی سیلندر) عبور می کند و موجب انبساط جرم و مقابله با نیروی(F) می شود. کاهش جریان حرارت موجب غلبه نیروی(F) و انقباض گاز می گردد. این سیستم نسبت به جریان جرم بسته است. در سیستم باز، انرژی و جرم بین محیط و سیستم عبور می کنند. سیستم ایزوله نیز سیستمی است که هیچ ارتباطی با محیط ندارد و جریان جرم یا انرژی از آن عبور نمی کند.
انرژی و انتروپی(Entropy) دو مفهوم بنیادی تحلیل های ترمودینامیکی هستند و از این نظر می توان، ترمودینامیک را علم انرژی و انتروپی نیز نامید. زیرا قواعد اصلی ترمودینامیکی بر پایه ی این دو مفهوم ارائه شده اند.
انرژی قابلیت و توانایی انجام کار است و فارغ از انواع، به طور کلی به دو شکل پتانسیل(Potential) و جنبشی(Kinetic) وجود داشته و ذخیره می شود.
چنانچه انرژی گرمایی(Thermal) را انرژی داخلی(Internal) مواد و ناشی از نیرو های بین مولکولی و حرکت مولکولها بدانیم، می توانیم انرژی پتانسیل را نیروی بین مولکولی مواد و انرژی جنبشی را سرعت حرکت مولکولها تعریف کنیم. انرژی پتانسیل وابسته به موقعیت نیز هست و بنا به مباحث دینامیک کلاسیک می توان مقدار ارتفاع و به تبع آن شتاب جاذبه را متناسب با انرژی پتانسیل دانست.
بنابراین مقدار انرژی پتانسیل از طریق رابطه ی زیر قابل محاسبه است:
( 1- 5 ) PE = mgz
PE : انرژی پتانسیل
m : جرم
g : شتاب جاذبه
z : ارتفاع از سطح افقی مبدا
همانگونه که اشاره شد انرژی جنبشی ناشی از سرعت مولکولهاست. بنابراین مقدار آن را می توان متناسب با سرعت، مطابق رابطه ی زیر تعیین کرد:
( 2- 5 ) KE = mV2/2
KE : انرژی جنبشی
V : سرعت
m : جرم
چگونگی چیدمان اتم ها و ترکیب مولکولی، انرژی شیمیایی(Chemical) و نیروی نگهدارنده پروتون ها و نوترون ها، انرژی اتمی یا هسته ای(Nuclwar) هستند.
سایر مفاهیم مورد استفاده در مباحث ترمودینامیک
گرما (Q) مکانیسمی برای انتقال انرژی از مرزهای یک سیستم بر اساس اختلاف دما است و جهت آن به سمت دمای کمتر است. یعنی انتقال گرما از جسمی با دمای بیشتر به جسمی با دمای کمتر صورت می گیرد.
کار نیز مکانیسمی از انتقال انرژی از مرزهای یک سیستم بر اساس اختلاف فشار یا نیروهای مشابه است و جهت آن همواره به سمت شرایط کم فشار است.
کار مکانیکی (W) نیز ناشی از جا به جایی یا جذب انرژی توسط مکانیسمی مانند توربین، کمپرسور هوای فشرده یا موتور احتراق داخلی است.
جریان کار نیز حمل یا انتقال انرژی به یک سیستم از محیط خارج سیستم است.
جریان کار به ازای جرم برابر است با فشار در حجم مخصوص یا حجم جا به جا شده به ازای واحد جرم :
( 3- 5 ) PV=جریان کار به ازای واحد جرم
مشخصه های ترمودینامیکی یک سیستم شامل دما (T) فشار (P) ، حجم مخصوص (V) و چگالی (ρ) است. سایر مشخصات ترمودینامیکی عبارتند از : انتروپی (s) و و انتالپی (h) و شکل انرژی از نظر پتانسیل و جنبشی و برخی از خواص ترکیبی، به عنوان مثال انتالپی متناسب است با انرژی داخلی به ازای وزن (u) به علاوه حاصل ضرب فشار در حجم مخصوص :
( 4 – 5 ) pv + u ≡ h
حالت سیستم نیز مرتبط با مشخصه های قابل اندازه گیری ترمودینامیکی است که در قالب دستگاه های مختصاتی بر اساس مولفه های مختلف مانند :
( فشار – دما ) ، ( دما – انتروپی ) ، ( فشار – انتالپی ) و یا ( فشار – حجم مخصوص ) تحلیل می شود.
فرایند حاصل تغییرات حالت است که منجر به تغییر برخی مشخصات سیستم می شود.
تعادل سیستم، میل سیستم برای متوازن شدن پس از یک فرایند یا تغییر حالت در یک سیستم است. در طول فرایند یا مرحله ی تغییر حالت، تعادلی وجود ندارد.
چرخه، حاصل چندین تغییر حالت متوالی یا فرایند است که سرانجام به حالت اولیه ختم می شود.
ماده خالص، ماده ای همگن با ترکیب شیمیایی تغییر ناپذیر است که می تواند در بیش از یک فاز وجود داشته باشد و در تمامی حالات ترکیب شیمیایی آن یکسان باقی بماند. آب مایع می تواند مخلوطی از مایع و بخار یا مخلوط مایع و یخ باشد و در عین حال ترکیب شیمیایی آن ثابت باقی بماند. در عین حال مخلوط هوای مایع و هوای گازی، ماده خالص محسوب نمی شود، زیرا ترکیب آن در دو حالت مایع و گاز متفاوت است.
اگر مایع در دما و فشار اشباع باشد ، مایع اشباع(Saturated Liquid) خوانده می شود.
اگر دمای مایع کمتر از دمای اشباع در فشار معین باشد، مایع مادون سرد(Subcooled) یا مایع متراکم شده(Compressed) نامیده می شود. مایع متراکم تحت فشار بیشتری از فشار اشباع در دمای معین است. چنانچه بخشی از ماده ی موجود مایع و بخشی دیگر بخار باشد، کیفیت براساس نسبت جرم بخار به جرم کل تعیین می شود. کیفیت ماده زمانی به آن اتلاق می شود که ماده دردما و فشار اشباع باشد.
اگر دمای بخار بیش از دمای اشباع آن باشد، آن را فوق داغ(Superheat) می نامیم و اگر دمای آن در دمای اشباع باشد، آن را بخار اشباع می نامیم و گاهی از اصطلاح بخار اشباع خشک برای کیفیت صد در صد آن استفاده می شود. فشار و دمای فوق داغ مستقل از یکدیگرند و می توان دما را مستقل از فشار و ثابت بودن آن افزایش داد. گازها را می توان بخار فوق داغ دانست.
انتروپی چیست
مفهوم انتروپی فارغ از علمی بودن ما را درگیر موضاعات فلسفی می کند، زیرا انتروپی بر بی نظمی و تحولات و گوناگونی حالت های ماده و انرژی دلالت دارد، که گاه در نظر گرفتن تمامی آن ها از دایره ی شناخت و پیش بینی خارج شده و اینجاست که فلسفه به عنوان مقدمه و ادامه دهنده علوم وارد بحث و گمانه زنی و نظریه پردازی می شود. شاید علم مقدمات فلسفه را تایید کند. در آن صورت شناخت علمی باز به مرزهایی خواهد رسید که مشاهدات و تجربیات مشخص و معینی در رابطه با آن وجود نداشته و یا حداقل تا مدت زمانی وجود ندارد. بنابراین بار دیگر گمانه زنی های فیلسوفانه و نظریه پردازی های مبتنی بر منطق و آرای فلسفی پا به میان می گذارند. این گونه است که می توانیم فلسفه را مقدمه و ادامه علوم بدانیم. انتروپی نیز از جمله مفاهیم پیچیده و نسبتا مبهمی است که میدان را برای نظریه پردازی های فلسفی باز می گذارد. اما از نظر ترمودینامیکی می توان انتروپی را درجه ای برای تعیین مقدار بی نظمی در یک سیستم بسته یا حجم کنترل دانست. به عبارت دیگر هر چه انتروپی بیشتر باشد ، درجه ی بی نظمی نیز بالاتر است. چنانچه نظم درونی مواد، مورد نظر باشد، می توانیم بگوییم که انتروپی گازها نسبت به مایعات و مایعات نسبت به جامدات بیشتر است، زیرا بی نظمی در آنها چنین نسبتی با هم دارند. چیزی که انتروپی را پیچیده و مرموزتر می کند، عدم امکان سنجش مستقیم آن به وسیله تجهیزات اندازه گیری است. انتروپی را تنها می توان به صورت غیر مستقیم و از طریق به کار گیری روابط ریاضی تعیین کرد. به طور کلی اگر بخشی از مفهوم انتروپی را در جنبش و جوشش مولکولی مواد جستجو کنیم، می توان گفت که سیستم ها در دماهای کمتر تمایل بیشتری به نظم از خود نشان می دهند و به همین نسبت، انتروپی آنها کمتر است. نماد انتروپی s واحد آن KJ/MOL یا BTU/LB است. همانگونه که مشخص است دما و جرم هر یک نقش اصلی در مقدار انتروپی دارند.
انرژی نیز قابلیت انجام کار است و به صورت های مختلفی به کار گرفته می شود و در این میان گرما نوعی انرژی پایه محسوب می شود و میل به بی نظمی در آن از هر صورت دیگری بیشتر است. از این رو مصادیق انتروپی در مورد گرما بارزتر و گویاتر است و بر همین اساس یکی از ارکان مقداری انتروپی، دما است.
آنچه به صورت مقدماتی در مورد انرژی و انتروپی آمد، در قالب قواعد ترمودینامیکی شکلی منسجم تر و ریاضی وار به خود می گیرند. بنابراین در ادامه و به اختصار نگاهی به این قواعد خواهیم داشت.
مباحث ترمودینامیکی بر بستر چهار قانون که بیشتر مبتنی بر صحت تجربی هستند تحت عناوین قوانین صفرم، اول، دوم و سوم طرح می شود.
قوانین صفرم و اول بستری برای طرح مباحث انرژی است، اما قوانین دوم و سوم قطع نظر از طرح مباحث مربوط به انرژی به طرح انتروپی نیز می انجامد.
بر اساس قانون صفرم، چنانچه دوجسم با جسم سومی هم دما باشند با یکدیگر نیز هم دما هستند.
بر اساس قانون اول، انرژی داخلی یا درونی تفاضلی است بین انرژی داده شده به یک سیستم و کار گرفته شده از آن.
بر اساس قانون دوم، جهت جریان حرارت محدود و مشخص است. به این معنا که جریان حرارتی از جسم گرم به سرد است و عکس آن امکان پذیر نیست مگر آنکه کار انجام شود.
بر اساس قانون سوم، صفر مطلق یک دمای حد و رسیدن به آن به معنای سکون مطلق است. رسیدن و یا پایین تر رفتن از چنین حدی غیر ممکن است.
قانون اول ترمودینامیک
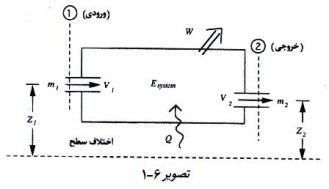
قانون اول ترمودینامیک اغلب قانون بقا یا پایستگی انرژی نامیده می شود. بر اساس این قانون، مقدار خالص انرژی اضافه شده به یک سیستم برابر است با افزایش انرژی ذخیره شده در سیستم. بنابراین انرژی از بین نمی رود، بلکه از شکلی به شکل دیگر در می آید. بر همین اساس می توان گفت که اختلاف انرژی ورودی و خروجی یک سیستم برابر است با افزایش انرژی سیستم. تصویر(6 – 1) جریان انرژی ورودی و خروجی را در یک سیستم ترمودینامیکی نمایش می دهد. در موارد عمومی برای جریان جرم ورودی و خروجی یک سیستم و تعادل انرژی در آن، روابط زیر مورد استفاده قرار می گیرد :
( 5 – 5 ) Ʃmin(u + pv + v2 / 2 + gz ) in – Ʃ mout ( u ++ v2 / 2 + gz ) out + Ǫ – w
= [ mƒ ( u + v2 / 2 + gz )ƒ – mi ( u + v2 / 2 + gz )i ]system
در جریان پایدار یا حالت پایدار که معادلات آن برای تحلیل تجهیزاتی همچون کمپرسورها، دیگ ها و کندانسورها مورد استفاده قرار می گیرد، شرط این است که حالت جرم در هر نقطه از حجم کنترل نسبت به زمان تغییر نکند. این نوع سیستم ها باز هستند و جریان جرم در نقطه یا نقاطی به آن وارد و از نقطه یا نقاطی از آن خارج می شود. در نتیجه خواهیم داشت :
( 6 – 5 )
در رابطه ی دوم(ṁ) دبی جرمی جریان است. چنانچه در رابطه اول به جای(u+pv) معادل آن یعنی(h) جای گیرد و طرف دوم معادله نیز ساده شود، رابطه ی زیر به دست خواهد آمد :
( 7 – 5 ) Q – W = [ m ( uf – ui ) ]system
و یا می توان گفت که تغییرات انرژی یک سیستم برابر است با مجموع گرمای داده شده و کار انجام شده :
( 8 – 5 ) ΔU = Q + W
قانون دوم ترمودینامیک
بر اساس قانون دوم ترمودینامیک جهت جریان یک فرایند تنها در یک جهت است و در خلاف جهت، امکان وقوع و پیش روی جریان وجود ندارد. به عنوان مثال در حالت طبیعی همواره انتقال حرارت از جسم گرم به جسم سرد صورت می گیرد و امکان انتقال گرما در جهت عکس، یعنی از جسم سرد به جسم گرم وجود ندارد. بنابراین در فرایندها باحالت های خود به خودی روبه رو خواهیم بود که از آنها نمی توان گریخت، و البته وجود حالات خود به خودی به معنای عدم وجود احتمالات در همان جهت و راستا نیست. اینجاست که انتروپی به عنوان بیان کننده ی فرایندهای خود به خودی موضوعیت پیدا می کند. انبساط گازها و یا سرد شدن جسم تا رسیدن به دمای محیط از جمله فرایندهای یک سویه یا بازگشت ناپذیری هستند که در نتیجه آنها انتروپی افزایش می یابد. این خود نوعی به تعادل رسیدن است، بنابراین نمی توان بی نظمی مصطلح در مورد انتروپی را منجر به عدم تعادل دانست. بی نظمی منتسب به انتروپی در واقع نوعی نگرش قراردادی است که در اصل با تعادل در تباین قرار می گیرد. با نگاهی خرده انگارانه می توانیم بگوییم که با روشن کردن یک کبریت به انتروپی جهان افزوده ایم؛ اما در این نگرش مقدار اثر گذاری مغفول واقع می شود. درست است که بگوییم اگر گرما از منبع گرم به منبع سردی منتقل شود انرژی جریان یافته و کاری انجام می شود و این جریان یک سویه با کاهش انرژی و افزایش انتروپی همراه است. به عبارت دیگر می توان گفت که انتقال انرژی از منبعی گرم تر به منبعی گرم، توام با انتروپی کمتری نسبت به انتقال انرژی از منبعی گرم به منبعی سرد است. قانون دوم ترمودینامیک از دو دیدگاه بیان می شود. یک دیدگاه که به نام کلوین – پلانک معروف است، بیان می دارد که در یک فرایند تبدیل انرژی گرمایی به کار هیچ گاه تبدیل کامل ممکن نیست. در واقع بازده عملکرد حاصل از کار یک موتور یا ماشین گرمایی که انرژی حرارتی را به کار مکانیکی تبدیل می کند، صد در صد نیست و بخشی از انرژی به صور دیگر از سیستم خارج می شود. این بیان نه تنها ناقض قانون اول ترمودینامیک نیست، بلکه در راستای همان تجربیات قرار می گیرد.
دیدگاه دیگر که بیان کلازیوس خوانده می شود، بیان می کند که انتقال گرما از یک جسم سرد به یک جسم گرم تر بدون انجام کار ممکن نیست. هر دو دیدگاه به گونه ای منفی و در جهت نفی امکان مشخصی هستند. بیان کلوین تبدیل صد در صد انرژی به کار را نفی می کند و بیان کلازیوس ساخت سیستم سرمایشی ایده ال را منکر می شود. دیدگاه کلازیوس بر حتمی بودن استفاده از کار مکانیکی برای عمل سرمایش تاکید دارد و از این نظر می تواند برای موضوع این کتاب که بحث در خصوص چیلرهای جذبی را محور کار قرار داده است، مهم و حائز اهمیت ویژه باشد. در هر حال این دو دیدگاه هم ارز یکدیگر هستند و با نقض یکی از آنها، دیگری نیز نقض می شود. از این نظر دیدگاه کلوین – پلانک نیز در ارتباط با موضوع کتاب حاضر نقش مهمی پیدا میکند. در واقع تمامی مباحثی که پس از این در مورد ضریب کارایی طرح خواهد شد، برگرفته از چنین دیدگاهی است. فرایندهای بازگشت ناپذیر در یک چرخه ی سرمایش که به طور قطع نیازمند اعمال کار مکانیکی است شامل افت فشارها در خطوط و مبدل ها و اصطکاک مکانیکی می شود. با کاهش فرایندهای بازگشت ناپذیر، بازده چرخه ی فرایند سرمایش افزایش پیدا می کند. در یک سیستم باز برای بیان قانون دوم ترمودینامیک بر اساس مفهوم انتروپی می توان چنین رابطه ای را نوشت :
( 9 – 5 ) dSsystem = δǪ / T +δmisi – δmese + dI
dSsystem : تغییرات انرژی کل در واحد زمان در خلا فرایند
δmisi : افزایش انتروپی ناشی از جرم ورودی
δmese : کاهش انتروپی ناشی از جرم خروجی
δǪ / T : تغییرات انتروپی ناشی از فرایند برگشت پذیر تبادل حرارت بین سیستم و محیط
dI : انتروپی ایجاد شده ناشی از فرایند بازگشت ناپذیر که همواره مقداری مثبت است .
معادله فوق را می توان بر اساس تغییرات انتروپی به صورت زیر نوشت :
( 10 – 5 ) δǫ = T [( δmese – δmisi) + δSsys – dI ]
مقدار تغییر انتروپی در فرایند های بازگشت پذیر و بازگشت ناپذیر یکسان است، بنابراین تعیین این تغییرات در یک مسیر به منزله تعیین مقدار در مسیر دیگر نیز هست. رابطه عمومی قانون دوم را می توان بر اساس انتگرال گیری از نرخ انتقال حرارت و دما و بر اساس تغییرات انتالپی به صورت زیر نوشت :
( 11 – 5 ) ( Sƒ – Si ) system = ∫rev δǪ / T + Ʃ( ms )in – Ʃ( ms)out + I
در نظر نگرفتن زمان و یکنواختی چرخه های کاربردی منجر به عدم تغییرات انتروپی می شود. بنابراین در این صورت انتروپی صفر شده و رابطه ی بالا را می توان برای چنین چرخه هایی و برای تعیین نرخ بازگشت ناپذیری به صورت زیر نوشت :
( 12 – 5 ) I = Ʃ( ms )out – Ʃ( ms )in – ∫ Ǫ / Tsurr
اگر دمای محیط برابر با دمای سیستم باشد معادله بالا برابر صفر خواهد شد. با ترکیب معادله ی بالا با معادله ی ( 6 – 5 ) معادله ی ( 13 – 5 ) به دست می آید :
( 13 – 5 ) I = m [ ( Sout – Sin ) – hout – hin / Tsurr ]
در چرخه های واقعی که بنا به دلایل مختلف نیازمند صرف کار بیشتری می شوند، مقدار کار مورد نیاز چرخه ی واقعی برابر است با دمای مطلق محیط به علاوه ی کار مورد نیاز ناشی از فرایندهای بازگشت ناپذیر. بنابراین کار واقعی را می توان از طریق رابطه ی زیر محاسبه کرد.
( 14 – 5 ) Wactual = Wreversible + T0ƩI
در چرخه های سرمایشی انتقال انرژی از یک ناحیه با دمای کم به یک ناحیه با دمای زیاد صورت می گیرد. به طور معمول ناحیه یا سیال دمای زیاد می تواند یک سطح حرارتی یا هوای محیط باشد.
ضریب کارایی یک سیستم سرمایشی نسبتی است بین سرمایش مفید(مقدار گرمای خارج شده از سیستم) به مقدار انرژی خالص ورودی به سیستم از منبع خارجی .
( 15 – 5 ) سرمایش مفید / مقدار انرژی خالص ورودی از منبع خارجی = COP
در سیستم های مکانیکی تراکم بخار، انرژی اولیه یا ورودی به طور معمول شکلی از کار ناشی از عملکرد تجهیزات مکانیکی یا الکتریکی مانند کمپرسورها است. بنابراین می توان نوشت :
( 16 – 5 ) COP = Ǫi / Wnet
در سیستم های سرمایش جذبی، انرژی حرارتی به طور مستقیم از یک مولد گرمایشی تامین می شود و در کنار آن کار مکانیکی ناشی از کارکرد پمپ ها و فن ها(مانند فن برج) نیز دخیل هستند. بنایراین در این مورد می توان نوشت :
( 17 – 5 ) COP = Ǫi / Ǫgen + Wnet
به طور معمول در سیستم های جذبی، انرژی ورودی به شکل کار در مقایسه با انرژی گرمایی ورودی بسیار اندک و قابل اغماض است. مقدار انحراف ضریب کارایی واقعی از ضریب کارایی بازگشت پذیر ایده آل، بازده سیستم را تعیین می کند :
( 18 – 5 ) COP / ( COP )rev =ηR
چرخه ی کارنو
چرخه ی کارنو، چرخه ای بازگشت پذیر است که بین دو منبع دمای ثابت عمل میکند. این چرخه ی تراکمی در یک وضعیت همچون یک نیروگاه بخار عمل نموده و در جهت عکس تبدیل به یک سیستم سرمایش تراکمی می شود. چرخه ی کارنو که از دو فرایند هم دما و دو فرایند آدیاباتیک تشکیل شده است.